Gaswisseling, transport en affiniteit
-
Gaswisseling is het uitwisselen van zuurstof (O2) en koolstofdioxide (CO2) in het bloed met de omgeving. Dit proces kan worden ingedeeld op twee niveaus: gaswisseling die plaatsvindt in de alveoli en gaswisseling die plaatsvindt in de weefsels.
Bij inademing komt zuurstof in de alveoli terecht, waarna zuurstof diffundeert richting het bloed in het capillairbed van de longen. Het linkerhartventrikel pompt het zuurstofrijke bloed vervolgens naar de perifere weefsels. Het weefsel neemt het zuurstof op en gebruikt dit voor het maken van energie in de vorm van ATP. Tijdens dit proces komt koolstofdioxide vrij wat vanuit het weefsel richting het bloed diffundeert. Het zuurstofarme en koolstofdioxiderijke bloed wordt via venen naar het hart geleid en uiteindelijk door het rechterhartventrikel weer richting de longen gepompt. Koolstofdioxide diffundeert uiteindelijk vanuit het capillairbed van de longen richting de alveoli om uitgeademd te worden.
Diffusie van zuurstof en koolstofdioxide gebeurt passief en wordt in stand gehouden door een verschil in partiële druk. Partiële druk is de druk van een bepaald gas in een gasmengsel op zijn omgeving. Een voorbeeld: de atmosferische druk op zeeniveau is 760 mmHg. Deze druk is de som van alle gassen in de atmosfeer bij elkaar, zoals zuurstof (160 mmHg), stikstof (600 mmHg) en een zeer kleine hoeveelheid koolstofdioxide en andere gassen. Elk gas in de atmosfeer oefent een bepaalde druk uit. Deze druk wordt de partiële druk genoemd en wordt aangeduid met de hoofdletter P. De partiële druk van zuurstof in de atmosfeer wordt daarom aangegeven als Po2 = 160 mmHg.
De partiële drukken van zuurstof en koolstofdioxide in de alveoli, het bloed en de weefsels verschillen van elkaar. Door de verschillende partiële drukken kan passieve diffusie plaatsvinden waarbij een hogere partiële druk van een gas altijd richting een lagere partiële druk gaat. Zie AFBEELDING 1 voor een overzicht van de relevante partiële drukken van koolstofdioxide en zuurstof in het lichaam.
Extra
1) De partiële druk die heerst in het bloed is alleen afhankelijk van de hoeveelheid gas dat is opgelost in het bloed. Voorbeeld: zuurstof wat is opgelost in het bloedplasma bepaalt de partiële druk in het bloed, terwijl zuurstof wat gebonden is aan hemoglobine geen effect heeft op de partiële druk. Door dit mechanisme kan er veel zuurstof richting het bloed diffunderen, omdat het grootste deel van het zuurstof wordt gebonden aan hemoglobine.
2) De Po2 in de atmosfeer is 160 mmHg, terwijl dat in de alveoli ongeveer 105 mmHg is. Er is een open verbinding tussen de alveoli en de atmosfeer dus zou het logisch zijn dat de Po2 hetzelfde is. Het verschil is onder andere te verklaren doordat zuurstof continu passief diffundeert richting de bloedbaan. Dit effect leidt tot een lagere Po2 in de alveoli ten opzichte van de atmosfeer. De hogere Pco2 in de alveoli ten opzichte van de atmosfeer is te verklaren doordat er continu CO2 vanuit de bloedbaan richting de alveoli diffundeert.
-
Zuurstof en koolstofdioxide worden op verschillende manieren vervoerd in het bloed. Zuurstof wordt vervoerd op twee manieren:
1) 2% is opgelost in het bloedplasma en cytosol (intracellulair vloeistof) van de erytrocyt.
2) 98% is gebonden aan hemoglobine in de erytrocyt.
Koolstofdioxide wordt op drie manieren getransporteerd:
1) 10% is opgelost in het bloedplasma en cytosol van de erytrocyt.
2) 25% is gebonden aan aminozuren in hemoglobine. Koolstofdioxide wat gebonden is aan hemoglobine wordt carbaminohemoglobine genoemd.
3) 65% wordt in de erytrocyt chemisch omgevormd tot bicarbonaat (HCO3-) en een waterstofion (H+). Deze reactie is reversibel (AFBEELDING 2). Het H+ bindt zich aan hemoglobine en wordt op deze manier gebufferd, omdat vrij H+ het bloed zuurder maakt (veel zuur is schadelijk). Het bicarbonaat verlaat de erytrocyt via een Cl-/HCO3- exchange kanaal en belandt in het bloedplasma.
-
Een erytrocyt kan veel zuurstof opnemen doordat er een grote hoeveelheid hemoglobine eiwitten aanwezig zijn. Hemoglobine is opgebouwd uit vier subunits (AFBEELDING 3). Elke subunit bestaat uit een heemgroep, waaraan een zuurstofmolecuul kan binden, en een polypeptideketen (alpha of bètaketen). Elk hemoglobine eiwit kan in totaal vier moleculen zuurstof binden, omdat er vier heemgroepen in een hemoglobine eiwit te vinden zijn. Als gemiddeld vier heemgroepen van alle hemoglobine eiwitten een zuurstofmolecuul hebben gebonden is er sprake van een 100% zuurstofsaturatie, op het moment dat er gemiddeld twee heemgroepen een zuurstofmolecuul hebben gebonden dan geldt een zuurstofsaturatie van 50% etc. Het meten van de zuurstofsaturatie is klinisch relevant, omdat een lage zuurstofsaturatie gepaard kan gaan met verschillende aandoeningen.
-
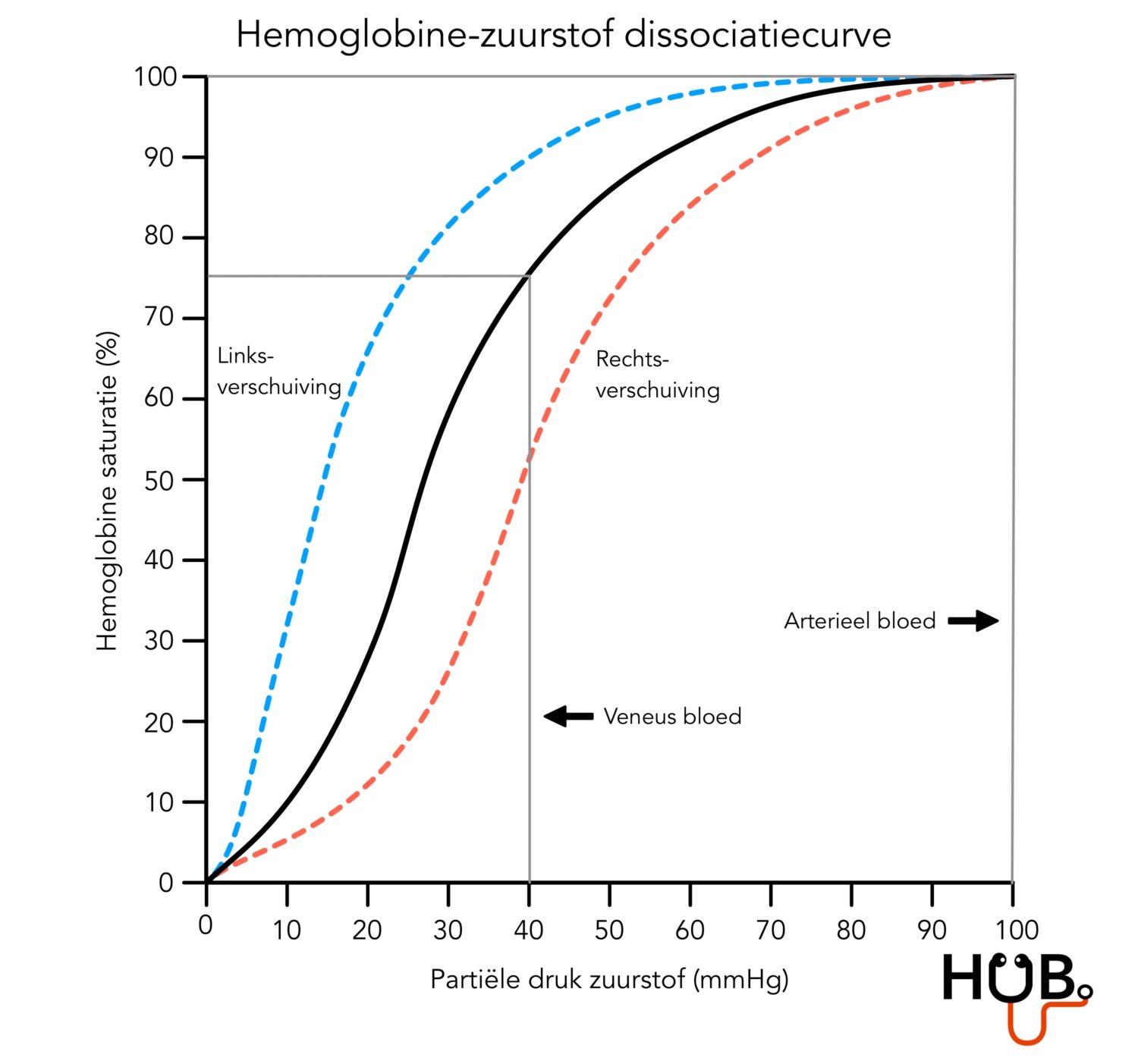
De mate van affiniteit, ofwel aantrekkingskracht, van hemoglobine voor zuurstof verschilt per situatie. Deze flexibiliteit is van groot belang. In de longen moet hemoglobine zo snel mogelijk zuurstof aantrekken; op dat moment is er sprake van een hoge affiniteit. In de weefsels gebeurt het tegenovergestelde. De affiniteit van hemoglobine voor zuurstof moet dan laag zijn, zodat zuurstof sneller kan worden afgestaan aan de cellen die zuurstof nodig hebben. Dit principe wordt weergegeven in een hemoglobine-zuurstof dissociatiecurve (AFBEELDING 4). Kort gezegd zorgt een hoge Po2, zoals in de capillairen van het longweefsel, voor een hoge affiniteit van hemoglobine voor zuurstof. In de weefsels heerst juist een lage Po2 en is er sprake van een lagere affiniteit van hemoglobine voor zuurstof.
Hier volgt een uitgebreidere omschrijving van dit proces:
De hemoglobine-zuurstof dissociatiecurve op AFBEELDING 4 geeft informatie over de affiniteit van hemoglobine voor zuurstof. In deze grafiek wordt de zuurstofsaturatie van hemoglobine uitgezet tegenover de partiële druk van zuurstof in het bloed. Wat opvalt is dat de curve een S-vorm heeft in plaats van een rechte lijn. Dat komt door de karakteristieken van het hemoglobine-eiwit. De S-curve kan het beste uitgelegd worden door de zwarte lijn op AFBEELDING 4 in drie stukken op te delen:
0 – 15 mmHg Po2: dit deel wordt gekenmerkt door een langzaam stijgende lijn. Hemoglobine heeft een lage affiniteit voor zuurstof in een omgeving met een zeer lage Po2. De langzame stijging is te danken aan het feit dat de vier subunits van hemoglobine tot elkaar worden aangetrokken als er nog geen zuurstofmoleculen zijn gebonden aan de heemgroepen. Hierdoor wordt het lastiger voor zuurstofmoleculen om zich te kunnen binden aan de heemgroep en duurt het langer voordat er saturatie optreedt.
15- 60 mmHg Po2: als er een zuurstofmolecuul bindt aan één van de vier subunits dan wordt het gemakkelijker voor andere zuurstofmoleculen om te binden aan de volgende subunit. De aantrekkingskrachten tussen de subunits worden namelijk verbroken. Als ook de tweede subunit zuurstof heeft gebonden, wordt het nog makkelijker voor zuurstofmoleculen om te binden aan de derde subunit enzovoort. De lijn wordt daardoor steiler.
Extra: als de Po2 onder de 60 mmHg terechtkomt, vermindert de affiniteit van hemoglobine voor zuurstof snel. Dat is handig, want de Po2 in de weefsels ligt rond de 40 mmHg. Zuurstof kan daardoor sneller worden afgestaan.
60 – 100 mmHg Po2: het merendeel van alle hemoglobine eiwitten is gesatureerd waardoor weinig zuurstofmoleculen meer kunnen binden [1]. De lijn vlakt af.
Extra : op grote hoogte of longschade kan er minder zuurstof worden opgenomen in het bloed wat leidt tot een lagere Po2. Toch is bij een Po2 van 60 mmHg al sprake van 85% zuurstofsaturatie, waardoor het lichaam in principe nog genoeg zuurstof aangevoerd krijgt om te kunnen functioneren. Het gebied tussen de 60-100 mmHg kan daarom worden gezien als een bufferzone.
Tot slot is de affiniteit van hemoglobine voor zuurstof afhankelijk van andere factoren waardoor de curve kan verschuiven. Een verschuiving naar rechts (rode lijn) betekent dat er sprake is van een verminderde affiniteit van hemoglobine voor zuurstof, waardoor snelle zuurstofafgifte aan weefsels kan worden bewerkstelligd. Een verschuiving naar links betekent dat er sprake is van een verhoogde zuurstofaffiniteit, waardoor weinig zuurstof wordt afgegeven aan weefsels. Dit zijn enkele factoren die invloed hebben op de curve:
Zuurgraad en Pco2: de curve verschuift naar rechts bij een hoge zuurgraad en naar links bij een lage zuurgraad in het bloed. De zuurgraad verhoogt bijvoorbeeld als er meer lactaat of CO2 in het bloed zit.
Temperatuur: de curve verschuift naar rechts bij een verhoging van de temperatuur (bijvoorbeeld tijdens het sporten) en naar links bij een verlaging van de temperatuur.
2,3 diphosphoglycerate (2,3 DPG): de curve verschuift naar rechts als er meer 2,3 DPG vrijkomt en naar links als er minder 2,3 DPG aanwezig is. Deze stof is een bijproduct van de glycolyse (proces betrokken bij het maken van ATP) in erytrocyten. 2,3 DPG aanmaak verhoogt onder omstandigheden van hypoxie, bijvoorbeeld als een persoon zich op grote hoogte bevindt [2].
Foetaal hemoglobine: de curve verschuift naar links, omdat foetaal hemoglobine een veel sterkere binding met zuurstof aangaat dan hemoglobine van volwassenen. Dit is handig, omdat gedurende de zwangerschap de foetus meer zuurstof kan binden vanuit het maternaal bloed.
-
Auteurs
Auteur: Lars Nijman, geneeskundestudent
Student reviewer: Bernice Roggeband, geneeskundestudent
Specialist reviewer: W. Evers, longartsLinks voor verdieping
Ventilatie: https://www.amboss.com/us/knowledge/respiratory-physiology
Gastransport en hemoglobineaffiniteit voor zuurstof: https://www.amboss.com/us/knowledge/erythrocyte-morphology-and-hemoglobin
Referenties
[1] Collins, J.-A., & Rudenski, A. (2015). Relating oxygen partial pressure, saturation and content: the haemoglobin–oxygen dissociation curve. Breathe, 11(3), 194–201. https://doi.org/10.1183/20734735.001415
[2] Costanzo, L. S. (2018). Physiology (6de editie). Elsevier.
Widmaier, E. P. (2016). Vander’s Human Physiology (14de editie). McGraw-Hill Education.
Laatst bijgewerkt op 08-11-2022